吉林大学生命科学学院分子酶学工程教育部重点实验室李全顺/韩浩博团队,前期研究中系统探究了miRNA在类风湿性关节炎发生发展中的关键角色,构建了多种基因治疗体系(Nat. Commun. 2023, 14: 944; J. Control. Release 2025, 383: 113832)。在此基础上,针对类风湿性关节炎异常激活的糖酵解信号通路,构建了上游为HSP70热响应启动子的血红素单加氧酶-1(HO-1)基因元件,通过近红外光驱动模式实现了该基因在病变关节组织中的精准表达,通过对底盘滑膜细胞表型的调控及炎症微环境的重塑,在类风湿性关节炎基因治疗方面取得了良好的效果。研究成果以Near-infrared light-driven metabolic reprogramming of synoviocytes for the treatment of rheumatoid arthritis为题,于2025年7月17日在学术期刊Nature Communications正式发表。该论文第一完成单位为吉林大学生命科学学院,博士生张虎刚为论文第一作者,李全顺教授、韩浩博副教授为该论文的共同通讯作者。

类风湿性关节炎是一种以慢性滑膜炎症、关节破坏为特征的自身免疫性疾病,其发生发展与细胞代谢紊乱和炎症微环境失衡密切相关。基因疗法虽具潜力,但健康组织中基因的非特异性表达限制了其疗效与安全性。为解决这一关键问题,本研究构建了APPC递送系统:其核心为具有高效光热转换能力的金纳米棒,表面包覆了硫酸软骨素修饰聚乙烯亚胺。该体系能够高效担载热诱导型HO-1质粒,构建具有CD44靶向能力的纳米复合物,胞内递送后能够降低胞外酸化率和耗氧率,逆转细胞炎症表型,降低炎症因子释放(图1)。将纳米复合物通过尾静脉注射到类风湿性关节炎动物模型后,其能够靶向富集于发炎关节组织处,通过NIR辐照实现HO-1基因在滑膜组织中的有效表达,进而诱导滑膜细胞发生代谢重编程,缓解类风湿性关节炎动物关节处肿胀、促炎因子分泌以及关节骨组织损伤等病理现象,展现出良好的治疗效果(图2)。本研究不仅有助于深入理解类风湿性关节炎发生发展机制,同时也为基于合成生物技术及纳米技术构建高效、精准、可控的基因治疗策略搭建了良好的平台,为其他代谢相关疾病的精准治疗提供了新思路。
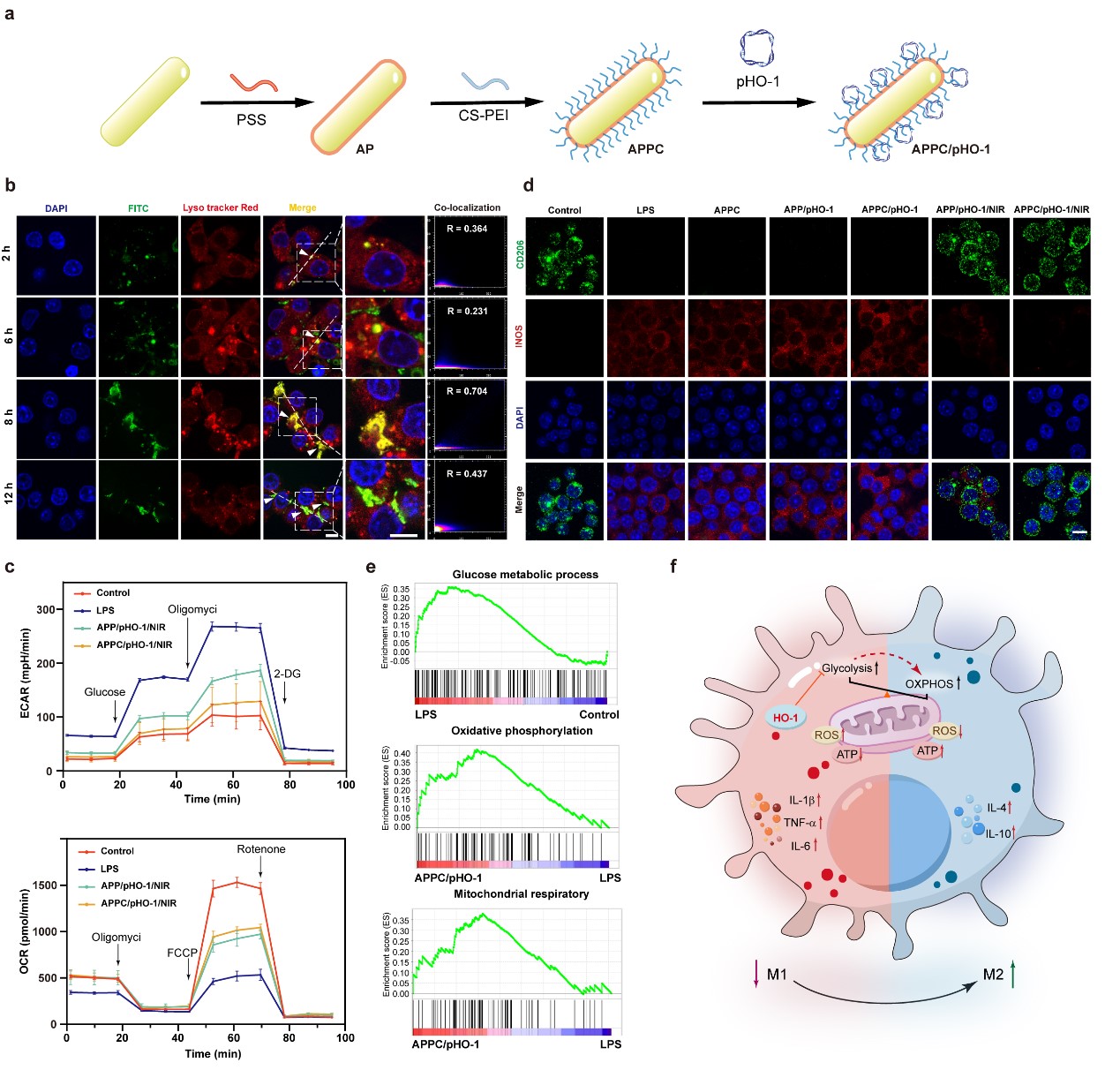
图1 APPC载体的构建及介导HO-1基因递送调控细胞代谢研究
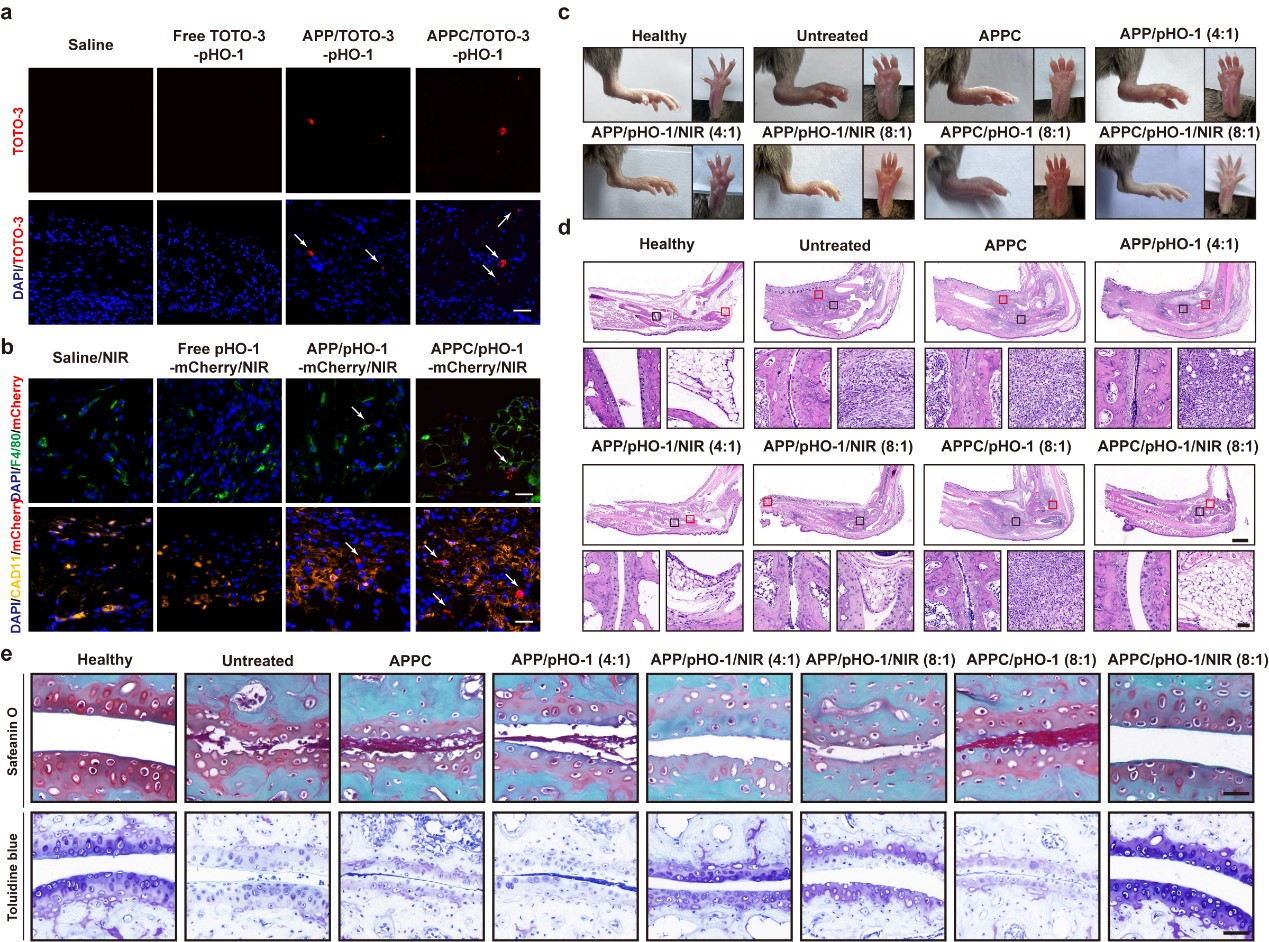
图2 APPC/HO-1基因治疗体系体内作用效果及机制分析
该研究工作得到了国家自然科学基金(32471315、32271319)、吉林省自然科学基金(长春创新发展联合基金项目)(YDZJ202301ZYTS537)、吉林省发展和改革委员会项目(2023C015、2024C013-8)、吉林大学第十届青年师生交叉学科培育项目(2024-JCXK-11)的资助。
全文链接:https://www.nature.com/articles/s41467-025-61923-7